Ванкомицин в покрытии магниевого имплантата предотвратит инфекции при протезировании костей
Ученые сформировали на образцах магниевого сплава кальций-фосфатное покрытие для костных имплантатов, содержащее антибиотик ванкомицин. Покрытие повысило коррозионную устойчивость сплава в два раза. При этом оно обладало выраженным антибактериальным действием, не подавляло рост человеческих клеток и предотвращало воспаление после имплантации образцов в ткани животных. Таким образом, полученные изделия повысят успешность и безопасность протезирования костей. Результаты исследования, поддержанного грантами Российского научного фонда (РНФ), опубликованы в Journal of Magnesium and Alloys.
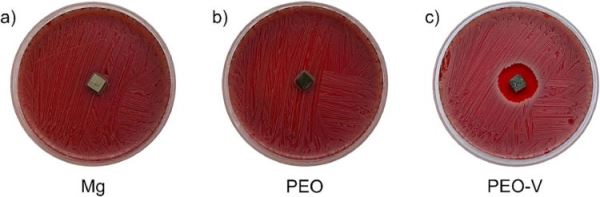
Результаты антибактериального теста. Изображения чашек Петри с культурой золотистого стафилококка, инкубированной в присутствии различных типов образцов: без покрытия (Mg, а), с покрытиями без (PEO, b) и с (PEO-V, c) внедренным ванкомицином. Источник: Константинэ Надараиа
Костные имплантаты обычно изготавливают из биоинертных металлов и сплавов, например титана. Такие соединения не растворяются в организме и в ряде случаев требуют удаления после восстановления костей. В отличие от них, магний и его сплавы удалять не нужно, так как они безопасно разлагаются и рассасываются в организме. Однако магниевые сплавы обладают низкой коррозионной стойкостью, то есть со временем они разрушаются, а продукты коррозии могут вызывать воспалительные процессы в организме. Чтобы предотвратить коррозию магниевых сплавов, но при этом сохранить их способность к разложению, ученые разрабатывают биосовместимые защитные покрытия. Однако на данный момент многие из таких покрытий плохо связываются с основой имплантата, расслаиваются и трескаются.
Исследователи из Института химии ДВО РАН (Владивосток) с коллегами изучили, как покрытие из фосфатов кальция влияет на коррозионную стойкость и биосовместимость имплантатов из сплава на основе магния. Выбранное покрытие состояло из элементов, присутствующих и усваивающихся в организме человека.
Чтобы сформировать покрытие, авторы поместили магниевые образцы в раствор, содержащий соединения кальция и фосфора, и пропустили через него электрический ток. В результате на сплаве был сформирован гидроксиапатит — основной минеральный компонент костной ткани. Затем в образцы с покрытием внедрили антибиотик ванкомицин, который используется для борьбы с инфекциями, возникающими после имплантации. Авторы рассчитывали, что такая обработка антибиотиком снизит вероятность развития инфекций после помещения имплантатов в живой организм. Толщина покрытия не превышала 0,1 миллиметра, при этом кальций и фосфор распределились по нему равномерно. На поверхности образца сформировались поры разного диаметра, глубины и формы. Такая поверхность будет способствовать хорошей приживаемости имплантата за счет прорастания соединительной ткани человека в поры покрытия.
Также химики показали, что покрытие, содержащее гидроксиапатит, в два раза повысило коррозионную стойкость изделий. Таким образом, оно будет предотвращать преждевременное разрушение имплантата и неконтролируемое высвобождение ионов магния в организм.
Затем исследователи изучили антибактериальные свойства сформированных магниевых образцов с покрытием. Для этого авторы поместили образцы в чашки Петри с культурой клеток золотистого стафилококка (Staphylococcus aureus) — бактерий, образующих биопленки на медицинских имплантатах и в прилегающих тканях и вызывающих воспаление. Внедрение в покрытие антибиотика позволило эффективно уничтожать бактерии.
Ученые установили, что антибиотик интенсивно выделялся из пор покрытия в первые четыре дня эксперимента. Так как имплантат-ассоциированные инфекции с наибольшей вероятностью возникают именно в первые дни после операции, выделение антибиотика будет активно подавлять их развитие. С седьмых суток концентрация ванкомицина в моделируемой жидкости организма почти не менялась, а к 28 суткам антибиотик полностью высвободился из пор покрытия. Таким образом, спустя неделю после имплантации оставшиеся низкие концентрации препарата будут предотвращать возвращение инфекций и образование бактериальной биопленки, но не будут мешать прикреплению клеток человека к поверхности имплантата.
Кроме того, авторы проверили, не токсично ли покрытие. Для этого образцы смешали с клетками пигментного эпителия сетчатки человека — одной из самых популярных клеточных культур, используемой учеными для тестирования совместимости веществ с человеческими клетками. Образцы с покрытием, содержащим антибиотик, практически не подавляли клеточный рост, в то время как сплав без покрытия подавлял рост клеток на 58%, что ставит под сомнение безопасность использования чистых магниевых сплавов в качестве имплантатов.
Также химики проверили, будет ли имплантация образцов в область позвоночника самцов крыс вызывать воспалительные реакции. У животных с имплантированными образцами без покрытия наблюдалась местная воспалительная реакция: постепенное образование продуктов коррозии привело к появлению гнойных капсул вокруг образцов. Напротив, в местах имплантации образцов с кальций-фосфатным покрытием не было обнаружено признаков воспаления. Биохимические показатели крови, анализ мочи, анализ свертываемости крови у экспериментальных животных после имплантации показали, что сформированные покрытия не вызывают системного воспаления в организме и не имеют токсического эффекта.
«Разработанное покрытие позволяет нивелировать негативные свойства магниевых сплавов, расширяя возможности их использования в имплантологии. Наши дальнейшие исследования будут направлены на улучшение полученных материалов, создание гибридных слоев, содержащих противоопухолевые и подавляющие разрушение костной ткани вещества», — рассказывает руководитель проекта, поддержанного грантом РНФ, Константинэ Надараиа, кандидат химических наук, старший научный сотрудник Института химии ДВО РАН.
Также в исследовании приняли участие ученые из Дальневосточного федерального университета (Владивосток), Национального научного центра морской биологии имени А.В. Жирмунского ДВО РАН (Владивосток), Краевого клинического кожно-венерологического диспансера (Владивосток) и НМИЦ «Лечебно-реабилитационный центр» (Москва).
Информация и фото предоставлены пресс-службой Российского научного фонда
Источник: scientificrussia.ru





